


| home |
Energier, frekvenser och våglängderEnergin hos en foton ges av sambandetE = h · f = h · c / λ där h = Plancks konstant = 6.626·10-34Js, f = fotonens frekvens mätt i Hz, c = ljushastigheten i vakuum, λ = fotonens våglängd mätt i meter. Energin för fotoner anges ofta i enheten elektronvolt (eV). 1 eV = 1.602·10-19J Energin hos en foton med våglängden λ kan då beräknas och anges i eV med formeln: E (eV) = h·c / ( λ·Q) där Q = 1.602·10-19J/eV. En foton med våglängden λ har en frekvens f. Sambandet mellan f och λ ges av: f = c/λ |
Atommodeller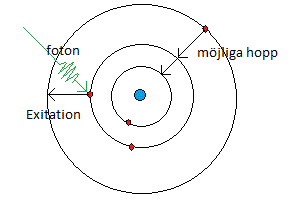 Kring den punktformiga atomkärnan cirklar elektronerna runt i skal. När en elektron hoppar från ett yttre skal till ett inre skal får elektronen lägre potentiell energi. Denna energiändring skickas ut i form av en foton.
Kring den punktformiga atomkärnan cirklar elektronerna runt i skal. När en elektron hoppar från ett yttre skal till ett inre skal får elektronen lägre potentiell energi. Denna energiändring skickas ut i form av en foton.Einre banan - Eyttre banan = Efoton Om en foton träffar en elektron i ett inre skal och fotonens energi exakt motsvarar energiskillnaden mellan det skal där elektronen befinner sig och ett yttre skal kan elektronen absorbera hela fotonens energi och hoppa ut till det yttre skalet. Efoton = Eyttre banan - Einre banan Om en elektron träffar atomen kan en elektron i atomen ta upp så mycket energi som behövs för att excitera den till ett yttre skal. Den infallande elektronen förlorar energi motsvarande det hopp som atomens elektron gör. Överskottet på den infallande elektronens energi behålls av den infallande elektronen. Detta sker till exempel i lysrör där elektroner kolliderar med kvicksilveratomer som blir exciterade och skickar ut ljus då den exciterade elektronen hoppar tillbaka till ett inre skal. Ett annat sätt att excitera en atom är att värma upp den. Då kan värmerörelserna hos atomerna bli så kraftiga att kollisioner mellan atomerna kan skicka ut en elektron till ett yttre skal så att atomen blir exciterad. När sedan elektronen hoppar tillbaka till ett inre skal skickas ljus ut. |
Ljus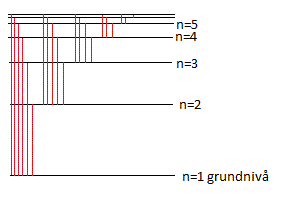 Ljus som skickas ut från en gasformigt ämne har våglängder motsvarande de energihopp som elektronen kan göra mellan atomens olika skal. Detta kan beskrivas med ett energinivådiagram.
Ljus som skickas ut från en gasformigt ämne har våglängder motsvarande de energihopp som elektronen kan göra mellan atomens olika skal. Detta kan beskrivas med ett energinivådiagram.För väteatomen kan energinivåerna beräknas med formeln En = - ER / n² där ER = Rydbergsenergin = 13,6 eV |
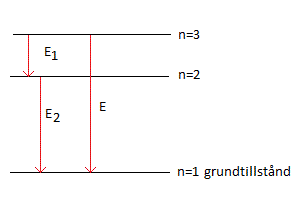 Om en elektron befinner sig i ett exciterat tillstånd och befinner sig i ett yttre skal kan den avge sin energi på flera sätt. Den kan hoppa direkt ned till grundtillståndet eller mellanlanda på mellanliggande skal.
Om en elektron befinner sig i ett exciterat tillstånd och befinner sig i ett yttre skal kan den avge sin energi på flera sätt. Den kan hoppa direkt ned till grundtillståndet eller mellanlanda på mellanliggande skal.E = E1 + E2 hc/λ = hc/λ1 + hc/λ2 hf = hf1 + hf2 Av den sista ekvationen ser man att frekvensen för ett hopp från nivån 3 -> 1 = summan av frekvensen för hopp nivå 3 -> 2 + frekvensen för hopp nivå 2 -> 1. f = f1 + f2 |
Kvanttal och Pauli-principenBohrs atommodell förklarar inte hur mer komplicerade atomer än väte fungerar. Därför har andra teorier tagits fram.Varje partikel har också en vågkaraktär. En elektron kan liknas vid en stående våg där våglängden är sådan att banans omkrets blir ett helt antal våglängder. Elektronens rörelsemängd beror på våglängden. p = h/λ och elektronens energi E = hc/λ har därmed en viss energi. Varje bana har då en speciell längd och speciell energi. Huvudkvanttalet n bestämmer skalet. Kvanttalet l bestämmer elektronvågens form. Det magnetiska kvanttalet ml bestämmer orienteringen i rummet. Det fjärde kvanttalet ms bestämmer elektronens spinn. Kvanttalet n kan ha värden 1, 2, ... Kvanttalen beror av varandra: För varje kvanttal n kan de övriga kvanttalen vara:
Inuti den röda molnet finns ett mindre sfäriskt moln med två elektroner som har huvudkvanttalet n = 1. Elektroner i de sfäriska molnen kallas s-elektroner. De är max 2 st. Elektroner i de 8-formade molnen kallas p-elektroner och de kan vara max 6 st. Nästa nivå är d-elektroner och kan bli upp till 10 stycken i skalet. För högre n-kvanttal blir elektronmolnen än mer komplicerade i form. Pauliprincipen säger att i en atom kan två elektroner inte ha samma uppsättning kvanttal. Uppsättningen måste skilja sig för minst 1 kvanttal. Allt eftersom antalet protoner i atomkärnan ökar, tillkommer elektroner i skalen. De fyller på så att de lägsta energinivåerna blir fulla först. Är alla platser fyllda i ett skal har vi fått en ädelgas. Med innersta skalet fyllt med 2 elektroner har vi Helium. När nästa skal är fyllt med 8 nya elektroner har atomen 10 elektroner och ämnet är ädelgasen Neon, osv. |
Heisenbergs osäkerhetsrelationKvantmekaniken innebär att man inte samtidigt kan bestämma olika storheter för en partikel. Enligt Heisenbergs osäkerhetsrelation kan man inte samtidigt bestämma läget för en partikel och dess rörelsemängd.Då partiklar också kan ses som ett vågpaket, har de en viss våglängd. Ju noggrannare man kan bestämma läget för en partikel, dvs desto mindre utsträckning vågpaketet har så måste vågpaketet bestå av fler och fler vågor med lite olika våglängder. Men då våglängden kan variera innebär det att rörelsemängden p = h/λ varierar och blir mer obestämd. Δx · Δp ≥ h/4π En liknande osäkerhet gäller för energi och tid. Ju längre en elektron kan befinna sig i ett kvanttillstånd, dvs. befinna sig på en viss energinivå i en atom, desto noggrannare kan man bestämma energin på den foton som elektronen lämnar ifrån sig då den hoppar ner till en lägre energinivå. ΔE · Δt ≥ h/4π |
LaserljusLaser = Light Amplification by Stimulated Emission of Radiation.Helium-Neon lasern utnyttjar egenskapen att en elektron kan befinna sig i ett exciterat tillstånd en längre tid. Först exciteras Heliumatomerna i gasblandningen genom elektronbombardemang. Sedan kolliderar Heliumatomen med en Neonatom. En Neon-elektron kan då ta upp energin och hamna i ett energitillstånd som inte omedelbart återgår till grundtillståndet. Villkor för att man ska få lasereffekt är att huvuddelen av Neonatomerna befinner sig i exciterat tillstånd. När en foton med rätt energi nu passerar den exciterade Neonatomen kan den stimuleras till att sända ut en likadan foton i samma riktning och med samma fas som den infallande fotonen. (Hade inte huvuddelen av Neonatomerna varit exciterade skulle fotonen istället fått en Neonatom att exciteras.) Ofta tillverkar man He-Ne-lasrar som ett smalt rör med parallella speglar i varje ända. De emitterade fotonerna speglas då i speglarna och åker fram och tillbaka i röret och kan på vägen stimulera fler Neonatomer till att avge fotoner. Ena spegeln görs halvgenomskinlig så att c:a 1% av ljuset kan tränga ut. Ljusets fotoner är alla i fas med varandra och har samma riktning. Genom att Neonatomens exciterade energitillstånd var långlivat blir frekvensen och rörelsemängden noggrant bestämd. Ljuset är parallellt och kan gå långt utan att spridas nämvärt och är i fas under långa sträckor, vilket gör det lämpligt för t.ex. interferensmätning. Man har mätt avståndet till Månen genom att skicka en laserpuls mot en spegel på Månen och mäta tiden som pulsen tar på sig att färdas fram och tillbaka. |
| home |